电化学是高中化学的重要内容,本模块知识理论性强且抽象,与现实生活联系密切,那么知识点你都掌握多少了呢?接下来小编为你整理了高中电化学基础知识点归纳,赶紧记下来哦~

【考点突破】
考点1 构成原电池的条件
1.要有活动性不同的两个电极(一种金属与另一种金属或石墨或不溶性的金属氧化物);
2.要有电解质溶液;
3.两电极浸入电解质溶液且用导线连接或直接接触。
考点2 原电池、电解(镀)池电极名称的确定
1.确定原电池电极名称的方法
方法一:根据电极材料的性质确定。通常是
(1)对于金属——金属电极,活泼金属是负极,不活泼金属是正极;
(2)对于金属——非金属电极,金属是负极,非金属是正极,如干电池等;
(3)对于金属——化合物电极,金属是负极,化合物是正极。
方法二:根据电极反应的本身确定。
失电子的反应→氧化反应→负极;得电子的反应→还原反应→正极。
2.确定电解(镀)池电极名称的方法
方法一:与外电源正极连接的一极是阳极、与负极连接的一极是阴极。
方法二:电极上发生氧化反应的是阳极,发生还原反应的是阴极。
考点3 原电池和电解池的比较
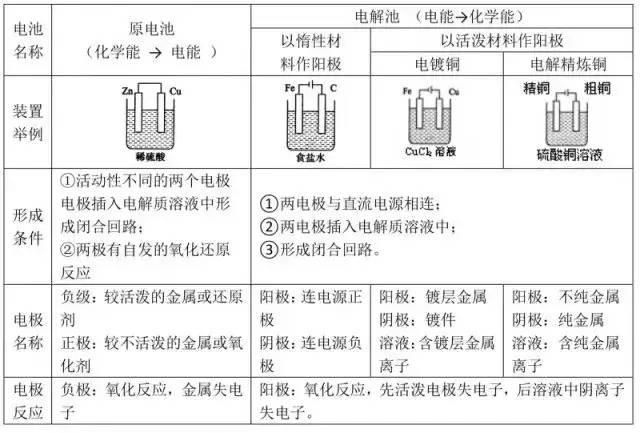
考点4 根据总反应式设计原电池
1.可设计成原电池的反应一般应满足如下条件:
(1)反应放热;(2)属于氧化还原反应。
2.步骤
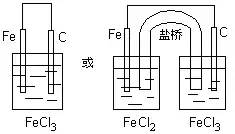
首先标明电子转移方向,根据电子转移方向判断正负极材料——失电子的为负极,得电子的为正极,其次选择相应的物质构成两个半电池——失电子金属和对应的产物构成一个半电池、得电子的离子和一较不活泼的金属或石墨构成另一半电池,最后用盐桥和导线组成闭合回路。
例如:将Fe+2FeCl3=3FeCl2设计成原电池装置
分析:Fe作负极,FeCl3作电解液,可设计成如下两种装置:
考点5 金属的腐蚀
1.金属腐蚀的实质:金属原子失去电子被氧化而消耗的过程。
2.金属腐蚀分为化学腐蚀和电化学腐蚀。
3.化学腐蚀实质:金属和非电解质或其他物质相接触直接发生氧化还原反应而引起的腐蚀。其腐蚀过程没有电流产生。
4.电化学腐蚀实质:不纯金属或合金在电解质溶液中发生原电池反应。电化学腐蚀过程有电流产生。
5.腐蚀的常见类型
(1)析氢腐蚀:在酸性条件下,正极发生2H++2e-==H2↑反应。
(2)吸氧腐蚀:在极弱酸或中性条件下,正极发生2H2O+O2+4e-==4OH-反应。
6.在同一电解质溶液中,金属腐蚀的快慢可用下列关系判断:电解原理引起的腐蚀>原电池引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
考点6 分析电极反应及其产物
原电池:负极:M-ne-==Mn+
正极:(1)酸性溶液中2H++2e-==H2↑
(2)不活泼金属盐溶液Mn++ne-==M
(3)中性、弱酸性条件下2H2O+O2+4e-==4OH-
电解(镀)池:
阳极:(1)若阳极是由活性材料(除C、Pt、Au等以外的其它金属)做成,阳极反应是阳极金属失去电子而被氧化成阳离子;
(2)若阳极是由C、Pt、Au等惰性材料做成,阳极反应则是电解液中阴离子在阳极失去电子被氧化。阴离子失去电子能力大小顺序为:I->Br->Cl->OH->含氧酸根>F-。
阴极:阴极反应一般是溶液中的阳离子得电子的还原反应,阳离子得电子能力大小顺序为:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+。必须注意的是,电镀时通过控制条件,Fe2+和Zn2+得电子的能力强于H+。
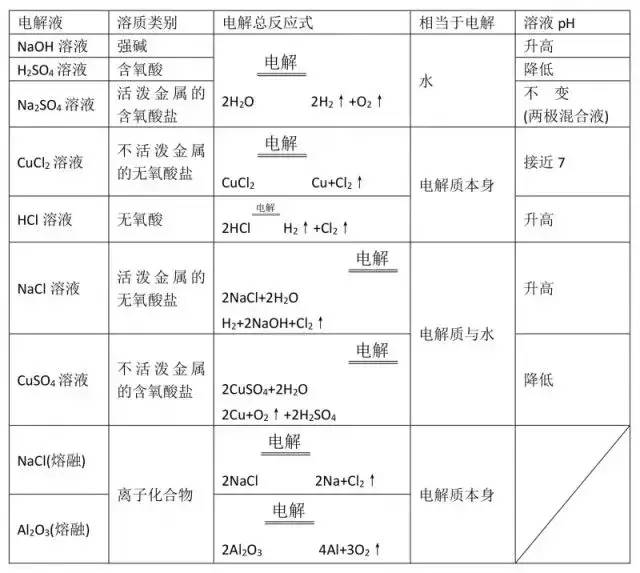
考点7 电解实例及规律
限时特惠:本站每日持续更新5-20节内部创业项目课程,一年会员
只需199元,全站资源免费下载点击查看详情
站长微信:
jjs406





