
一、利用有机物燃烧反应的方程式进行计算
有关化学方程式
由上可知,相同碳原子数的烯烃(环烷烃)与一元饱和醇完全燃烧时,耗氧量相同(把
:相同碳原子数的炔烃(二烯烃)与醛(酮)及饱和二元醇完全燃烧时,耗氧量相同(醛:
饱和二元醇:
);相同碳原子数的羧酸(酯)与三元醇完全燃烧,耗氧量相同(羧酸:
→
饱和三元醇:
二、通过实验确定乙醇的结构式
由于有机化合物中存在着同分异构现象,因此一个分子式可能代表两种或两种以上具有不同结构的物质。在这种情况下,知道了某一物质的分子式,常常可利用该物质的特殊性质,通过定性或定量实验来确定其结构式。例如:根据乙醇的分子式和各元素的化合价,乙醇分子可能有两种结构:
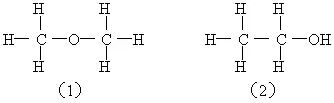
为了确定乙醇究竟是哪一种结构,我们可以利用乙醇跟钠的反应,做下面这样一个实验。实验装置如右下图所示。在烧瓶里放入几小块钠,从漏斗中缓缓滴入一定物质的量的无水乙醇。乙醇跟适量钠完全反应放出的H2把中间瓶子里的水压入量筒。通过测量量筒中水的体积(应包括由广口瓶到量筒的导管内的水柱的体积),就可知反应生成的H2的体积。
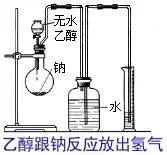
讨论:下面是上述实验的一组数据:
根据上述实验所得数据,怎样推断乙醇的结构式是(1),还是(2)呢?
由于0.100 mol C2H6O与适量Na完全反应可以生成1.12 L H2,则1.00 mol
C2H6O与Na反应能生成11.2 L H2,即0.5 mol H2,也就是1 mol H。这就是说在1个C2H6O分子中;只有1个H可以被Na所置换,这说明C2H6O分子里的6个H中,有1个与其他5个是不同的。这一事实与(1)式不符,而与(2)式相符合。因此,可以推断乙醇的结构式应为(2)式。
问题与思考
1.确定有机物分子式一般有哪几种方法?
2.运用“最简式法”确定有机物分子式,需哪些数据?
3.如何运用“商余法”确定烃的分子式?
问题与思考(提示)
1、最简式法;直接法;燃烧通式法;商余法(适用于烃的分子式的求法等
2、①有机物各元素的质量分数(或质量比)
②标准状况下的有机物蒸气的密度(或相对密度)
3、
则为烯烃,环烷烃.
②若余数=2,则为烷烃.
③若余数=-2,则为炔烃.二烯烃
④若余数=-6,则为苯的同系物.
若分子式不合理,可减去一个C原子,加上12个H原子有机物分子式的确定典型例题
例题精讲
一、有机物分子式的确定
例1实验测得某碳氢化合物A中,含碳80%、含氢20%,求该化合物的实验式。又测得该化合物的相对分子质量是30,求该化合物的分子式。
解:(1)实验式是表示化合物分子所含各元素的原子数目最简单整数比的式子,求化合物的实验式即是求该化合物分子中各元素原子的数目(N)之比。
=1∶3
该化合物的实验式是CH3。
(2)设该化合物分子中含有n个CH3,则:
该化合物的分子式是C2H6。
答:该碳氢化合物的实验式是CH3,分子式是C2H6。
例22.3g某有机物A完全燃烧后,生成0.1 mol CO2和2.7gH2O,测得该化合物的蒸气与空气的相对密度是1.6,求该化合物的分子式。
分析:根据实验,该有机物燃烧的产物只有CO2和H2O,因此,该有机物中一定含有C和H;至于O,由于其可能全部来自于燃烧时空气所提供的氧气,也可能来自于该有机物本身。因此,该有机物分子中是否含有O,还需要通过计算反应物中C、H质量之和并与该有机物质量进行比较后,才能作出判断。该有机物的相对分子质量,则可以利用实验测出的相对密度来求。
解:(1)求2.3g该有机物中组成元素的质量:
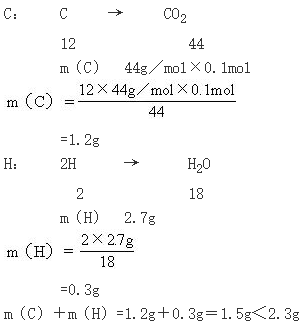
该有机物中C的质量与H的质量之和(1.5g)小于该有机物的质量(2.3g),因此该有机物A中还含有O,其质量为:
m(O)=m(A)-m(C)-m(H)
=2.3g-1.5g
=0.8g
(2)求该有机物的相对分子质量:
Mr(A)=d×Mr(空气)
=1.6×29
=46
(3)求该有机物分子中各元素原子的数目:
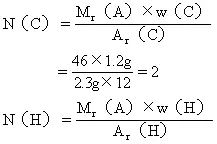
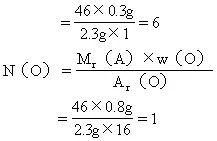
答:该有机物的分子式是C2H6O。
例30.60g某饱和一元醇 A,与足量的金属钠反应,生成氢气112mL(标准状况)。求该一元醇的分子式。
解:饱和一元醇的通式为CnH2n+1OH,该一元醇的摩尔质量为M(A)。
=60g/mol
该一元醇的相对分子质量是60。
根据该一元醇的通式,有下列等式:
12n+2n+1+16+1=60
n=3
答:该一元醇的分子式是C3H7OH。
二、通过实验确定乙醇的结构式
例4某烃含碳氢两元素的质量比为3∶1,该烃对H2的相对密度为8,试确定该烃的分子式.
分析:解法一:Mr=2×8=16,M=16g·mol-1,1mol烃中含C、H的物质的量为:
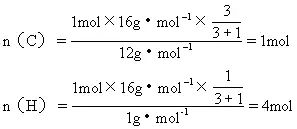
所以该烃的分子式为CH4.
解法二:烃分子中C、H原子个数比为:
最简式为CH4,式量为16.
因为Mr=16,故该烃的分子式为CH4.
答案:CH4
例5已知第一种气态有机物在标准状况下的密度为2.59g/L,第二种气态有机物对空气的相对密度为1.87,第三种气态有机物在标准状况下250mL质量为0.49g.求这三种有机物的相对分子质量.
分析:计算相对分子质量有三种不同方法
1.根据标准状况下气体的密度计算相对分子质量.根据标准状况的气体密度计算气体的摩尔质量,其数值即为相对分子质量.M=22.4×d如第一种有机物M=22.4×2.59=58
2.根据气体相对密度计算相对分子质量.M=DA×MA用相对密度乘相对气体的相对分子质量.如第二种有机物M=1.87×29=54
3.根据标准状况下,一定质量气体的体积计算相对分子质量.
答案:58、54、 44
例6某气态碳氢化合物中含碳75%,它的密度是同温同压下氢气密度的8倍,求有机物的分子式.
分析:计算推断分子式此题有三种方法
1.基本方法:先根据测得的气体密度计算气体的摩尔质量,然后计算1mol气态有机物中各元素原子的物质的量,最后确定该气态有机物的分子式.M=8×2=16
所以该有机物的分子式为CH4
2.最简式法:根据已知先求出摩尔质量,再据质量分数求出碳氢原子个数比,然后找到最简式式量与相对分子质量的关系,最后确定分子式.M=8×2=16,
所以最简式为CH4其式量=16,设分子式为(CH4)n,因为最简式式量=相对分子质量,所以分子式就是最简式,即为CH4
3.商余法:根据碳氢化合物中对其相对分子质量碳、氢原子的影响大小,用碳相对原子质量除以相对分子质量,所得商的整数部分就是烃分子中所含碳原子数的最大值,而余数就是氢原子数的最小值.注意从
为CH4
例7某烃1.68g,完全燃烧生成CO25.28g和H2O2.16g,经测定这种烃在标准状况下的密度为3.75g/L则其分子式是[]
A.CH4
B.C3H8
C.C4H10
D.C6H12
分析:本题是计算推断分子式的又一种类型,就是利用烃的完全燃烧反应方程式列出比例式求解类型.设烃分子式为CxHy,则有
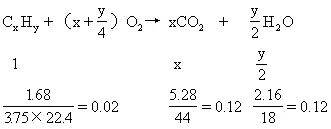
解得x=6 y=12
答案:D.
例82.3g某有机物A完全燃烧后,生成0.1molCO2和2.7g H2O,测得该化合物的蒸气与空气的相对密度是1.6,求该化合物的分子式.
分析:根据实验,该有机物燃烧的产物只有CO2和H2O,因此,该有机物中一定含有C和H;至于O,由于其可能全部来自于燃烧时空气所提供的氧气,也可能来自于该有机物本身.因此,该有机物分子中是否含有O,还需要通过计算反应物中C、H质量之和并与该有机物质量进行比较后,才能作出判断.该有机物的相对分子质量,则可以利用实验测出的相对密度来求.
(1)求2.3g该有机物中组成元素的质量:
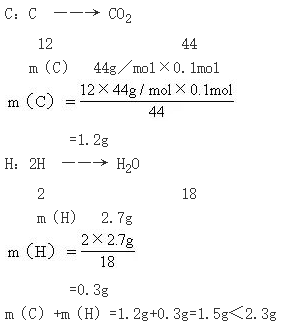
该有机物中C的质量与H的质量之和(1.5g)小于该有机物的质量(2.3g),因此该有机物A中还含有O,其质量为:
m(O)=m(A)-m(C)-m(H)
=2.3g-1.5g
=0.8g
(2)求该有机物的相对分子质量:
Mr(A)=d×Mr(空气)
=1.6×29
=46
(3)求该有机物分子中各元素原子的数目:
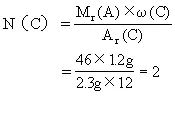
答案:该有机物的分子式是C2H6O.
例9标准状况下,密度为0.717g/L的某气态烃0.56L,在足量氧气中充分燃烧,反应后的气体先通过无水氯化钙,氯化钙增重0.9g;再通过氢氧化钠溶液,溶液增重1.1g.通过计算判断此气态烃的分子式,并画出其分子空间结构的示意图.
分析:本题是在已知有机物完全燃烧时,涉及的有关物质量关系,判断其分子组成的典型定量计算题.其解法有三种.
第一种解法是通过该烃燃烧生成的CO2和H2O的量,即本题中燃烧生成气体经过NaOH溶液和无水氯化钙后,两者增重的量,计算出烃中的C、H元素的质量比,进而求得实验式.再根据题中该气态烃在标准状况下的密度,求得其相对分子质量.最后由实验式和相对分子质量.判断它的分子组成.然而本题所给数据,求得实验式为CH4.依据烃的分子组成中,C原子个数为n时,H原子的最多个数不大于(2n+2)个的规律,即可确定此实验式就是所求的分子式.
第二种解法是通过烃的燃烧通式:
计算该烃1mol完全燃烧时,生成CO2和H2O物质的量,从而求得烃分子中C、H元素原子个数,求得其分子式,第三种解法是由本题特点决定的解法特例.即通过该烃在标准状况下的气体密度、计算相对分子质量为16.而相对分子质量为16的烃,是相对分子质量最小的甲烷,其分子式为CH4.如上各解法均可求得该烃为甲烷,就可画出表示甲烷分子空间结构的正四面体分子构型.
答案:
解法1:设该烃中C、H元素的质量分别为x、y g.
根据题意和题中数据:
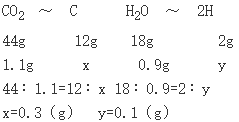
烃中C、H元素原子个数比
该烃实验式为CH4,式量为16.
该烃相对分子质量=0.717×22.4=16
该烃分子式为CH4,其分子空间结构示意图见下一解法的解题过程.
解法2:设该烃为CmHn.此烃1mol完全燃烧生成CO2和H2O分别为xg和yg.
0.56∶22.4=1.1∶x 0.56∶22.4=0.9∶y
x=44(g)y=36(g)
该烃分子式为CH4.其分子空间结构示意图为
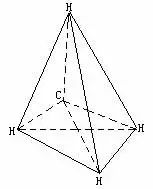
解法3:该烃摩尔质量=0.717×22.4=16(g/mol),只能是有机物中相对分子质量最小的CH4.
例10标准状况下4.48L某烯烃和CO的混合气体与足量的氧气混合点燃,使之反应,将反应完毕后生成的气体通过浓硫酸,浓硫酸增重7.2g,并测得剩余气体中CO2为11.2L(标准状况),求此烯烃分子式.
烧方程式列方程求解.
设混气中烯烃为xmol,则CO为(0.2-x)mol.
答案:烯烃分子式为C4H8.
例11某有机物的蒸气完全燃烧时需三倍于其体积的氧气,产生二倍于其体积的CO2,该有机物可能是[].
A.C2H4
B.C2H5OH
C.CH3CHO
D.CH3COOH
分析:首先判断为C2化合物,但无助于选择,因为4个选项均是C2化合物,故关键是利用耗氧量进行选择.关于耗氧量的选择有两种解法求解.
解法一用通式求解.由:
得:A.C2H4~3O2B.C2H5OH~3O2
解法二用“氢二氧一可内消”原则求解.关于(B)、(C)、(D)三项,均是烃的含氧衍生物,不必用常规关系式CxHyOz~(x+
CxHy(z可为0),即:(B)C2H5OH~C2H4(C)CH3CHO~C2H2(D)CH3COOH~C2
答案:AB
例12mg的饱和一元醇,在氧气中完全燃烧后,产生14.4g水和13.44L(标准状况下)二氧化碳气体.
(1)试确定该醇的化学式.
(2)m的值是多少?
分析:根据mg饱和一元醇燃烧后产生的水和CO2的量可分别求得mg饱和一元醇中H和C的物质的量,二者之比正好等于饱和一元醇通式CnH2n+2O中2n+2与n的比,于是可求得n值,从而就能确定其化学式.再根据化学式和其燃烧方程式及产生CO2或水的差,就能求出m的值.
(1)设饱和一元醇的化学式为CnH2n+2O
该饱和一元醇的化学式为C3H8O.
60∶m=3∶0.6 m=12
答案:(1)C3H8O
(2)m=12
往期精彩
限时特惠:本站每日持续更新5-20节内部创业项目课程,一年会员
只需199元,全站资源免费下载点击查看详情
站长微信:
jjs406





